محلول بافر چیست؟ معرفی انواع، ویژگی ها و کاربردهای آن
محلول بافر یکی از پرکاربردترین محلول های مورد استفاده در علوم مختلف است که هدف اصلی آن حفظ پایداری pH است. این ویژگی باعث می شود که افزودن مقدار مشخصی از اسید یا باز، تأثیر زیادی بر pH محلول نگذارد. توانایی کنترل و تثبیت pH، محلول بافر را به ابزاری ضروری در تحقیقات علمی، کاربردهای صنعتی و فرآیندهای زیستی تبدیل کرده است.

محلول بافر چیست؟
محلول بافر به محلولی اطلاق می شود که توانایی حفظ pH خود را در برابر تغییرات کوچک ناشی از افزودن مقادیر کم اسید یا باز دارد. این ویژگی به دلیل وجود یک اسید ضعیف و یا باز ضعیف همراه با نمک مزدوج آن ها در محلول است. این سیستم به گونه ای طراحی شده است که قادر است یون های هیدروژن (H+) و هیدروکسیل (OH-) را جذب و یا آزاد کند و بنابراین pH محلول را در محدوده مشخصی ثابت نگه دارد.
محلول های بافر در بسیاری از واکنش های شیمیایی و بیولوژیکی که به pH خاصی نیاز دارند، کاربرد دارند. در واقع، محلول بافر یکی از ابزارهای اساسی در علوم شیمی، زیست شناسی، پزشکی و بسیاری از زمینه های صنعتی است که به کنترل دقیق pH کمک می کند.
به طور کلی، محلول های بافری از یک جفت اسید ضعیف و نمک آن یا یک جفت باز ضعیف و اسید مزدوج آن تشکیل می شوند. این جفت ها در تعادل شیمیایی قرار دارند و می توانند با تغییرات ناگهانی در pH مقابله کنند.
ویژگی های محلول بافر
محلول بافر به عنوان یکی از ضروری ترین ابزارها در علوم مختلف، ویژگی های منحصر به فردی دارد که آن را از سایر محلول ها متمایز می کند. این ویژگی ها در تضمین پایداری و دقت در فرآیندهای شیمیایی، زیستی و صنعتی بسیار مهم هستند.
پایداری pH: یکی از اصلی ترین ویژگی های محلول بافر، توانایی حفظ pH در یک محدوده ثابت است. این خاصیت باعث می شود که افزودن اسید یا باز به محلول تغییرات pH را به حداقل برساند. این ویژگی به دلیل وجود تعادل میان اسید ضعیف و باز مزدوج آن یا باز ضعیف و اسید مزدوج آن است.
کنترل واکنش ها: محلول های بافر به عنوان واسطه هایی عمل می کنند که شرایط لازم برای انجام واکنش های حساس را فراهم می کنند. در بسیاری از فرآیندهای بیولوژیکی و شیمیایی، کوچک ترین تغییر در pH می تواند منجر به توقف یا تغییر نتایج واکنش شود. محلول بافر با جلوگیری از این تغییرات، عملکرد دقیق و مداوم واکنش ها را تضمین می کند.
ترکیب شیمیایی متعادل: محلول های بافر از یک جفت اسید و باز تشکیل شده اند که به صورت تعادلی عمل می کنند. به طور مثال:
- در یک محلول بافر اسیدی، اسید ضعیف به سرعت با یون های H+ اضافی واکنش داده و اثر آن ها را خنثی می کند.
- در یک محلول بافر بازی، باز ضعیف با یون های OH- واکنش می دهد و آن ها را از محلول حذف می کند.
این واکنش ها باعث تثبیت pH در محلول می شوند.

محدوده عملکرد مشخص: هر محلول بافر دارای یک محدوده خاص از pH است که در آن بهترین عملکرد را دارد. این محدوده معمولاً به pKa یا pKb اجزای تشکیل دهنده بافر وابسته است. به طور کلی، عملکرد مطلوب محلول بافر در حدود یک واحد بالاتر یا پایین تر از pKa یا pKb اتفاق می افتد. این محدوده به کاربران امکان می دهد تا بر اساس نیاز آزمایش یا فرآیند خود، محلول بافر مناسب را انتخاب کنند.
تنوع در کاربرد: محلول های بافر در بسیاری از زمینه ها قابل استفاده هستند. آن ها می توانند در شرایط دمایی مختلف و در حضور مواد شیمیایی گوناگون پایداری خود را حفظ کنند. این ویژگی باعث می شود که محلول بافر در فرآیندهای آزمایشگاهی، صنعتی و زیستی عملکرد مناسبی داشته باشد.
حفظ فعالیت مواد حساس: بسیاری از مولکول های زیستی مانند پروتئین ها، آنزیم ها و DNA فقط در محدوده خاصی از pH پایدار می مانند. محلول های بافر با تثبیت pH از تخریب یا غیرفعال شدن این مولکول ها جلوگیری کرده و شرایط مطلوب برای عملکرد آن ها را فراهم می کنند.
سهولت تهیه و تنظیم: محلول های بافر به راحتی قابل تهیه هستند. انتخاب یک جفت اسید و باز مناسب و تنظیم نسبت آن ها با استفاده از ابزارهایی مانند pH متر، امکان ساخت محلول بافر برای هر محدوده pH مورد نیاز را فراهم می کند.
تطبیق پذیری با محیط های مختلف: محلول های بافر در محیط های زیستی مانند خون و سلول ها به طور طبیعی وجود دارند. این ویژگی طبیعی باعث می شود که این محلول ها به راحتی در فرآیندهای زیستی، آزمایشات پزشکی و درمانی استفاده شوند. برای مثال، بافرهای طبیعی در بدن انسان، مانند بافر بی کربنات، نقش حیاتی در حفظ pH خون و عملکردهای متابولیکی ایفا می کنند.
مقاومت در برابر تغییرات غلظت یون: محلول های بافر قادرند تا تغییرات غلظت یون های H+ و OH- را کنترل کرده و اثر آن ها را خنثی کنند. این ویژگی، به خصوص در واکنش هایی که طی آن غلظت یون های اسیدی یا بازی تغییر می کند، بسیار حائز اهمیت است.
کاربردهای محلول بافر
در آزمایشگاه های بیولوژیکی و شیمیایی
محلول های بافر در تحقیقات علمی برای تثبیت شرایط آزمایشگاهی به کار می روند. بسیاری از واکنش های شیمیایی یا فرآیندهای زیستی به شدت وابسته به pH هستند. برای مثال:
- در آزمایشات زیستی، محلول بافر برای نگهداری فعالیت آنزیم ها استفاده می شود، زیرا آنزیم ها فقط در محدوده خاصی از pH فعالیت دارند.
- در آزمایشات شیمیایی مانند واکنش های اسیدی یا بازی، محلول بافر مانع از تغییرات ناگهانی pH می شود که می تواند نتیجه آزمایش را تحت تأثیر قرار دهد.
در تولید مواد غذایی و دارویی
- در صنایع غذایی، کنترل pH برای بهبود ماندگاری و کیفیت محصول ضروری است. بافرها در تولید نوشیدنی ها، فرآورده های لبنی و مواد غذایی کنسروی استفاده می شوند.
- در صنعت داروسازی، محلول های بافر برای حفظ پایداری داروها و جلوگیری از تخریب آن ها در حین نگهداری یا استفاده به کار می روند. به عنوان مثال، در تولید قطره های چشمی یا سرم های تزریقی، محلول بافر از تحریک یا آسیب به بافت ها جلوگیری می کند.
در محیط زیست
محلول های بافر نقش حیاتی در سیستم های طبیعی دارند. برای مثال:
- در بدن انسان، سیستم بافری خون مانند بافر بی کربنات کمک می کند تا pH خون در محدوده طبیعی باقی بماند. این تعادل برای جلوگیری از مشکلات جدی مانند اسیدوز یا آلکالوز ضروری است.
- در خاک، بافرها به حفظ تعادل شیمیایی خاک کمک می کنند و از تغییرات ناگهانی pH که ممکن است بر رشد گیاهان تأثیر بگذارد، جلوگیری می کنند.
- در سیستم های صنعتی، محلول های بافر در فرآیندهای صنعتی برای کنترل pH در مراحل مختلف تولید و تصفیه استفاده می شوند. برای مثال، در تصفیه آب و فاضلاب، محلول های بافر برای حفظ تعادل pH به کار می روند تا فرآیند تصفیه بهینه باشد.
انواع محلول بافر
محلول های بافر بر اساس ترکیب شیمیایی و نوع عملکردشان به دسته های مختلفی تقسیم می شوند. هر نوع محلول بافر برای محدوده خاصی از pH و کاربردهای ویژه ای طراحی شده است. در ادامه، رایج ترین انواع محلول بافر و ویژگی های آن ها توضیح داده می شوند.
- بافر اسیدی:
این نوع محلول بافر برای حفظ pH در محدوده اسیدی استفاده می شود. بافرهای اسیدی معمولاً از یک اسید ضعیف و باز مزدوج آن تشکیل می شوند. ویژگی های مهم این نوع بافر عبارتند از:
- مناسب برای واکنش هایی که نیاز به pH پایین دارند.
- توانایی خنثی سازی یون های OH- و جلوگیری از افزایش pH.
نمونه رایج: بافر استات، که از ترکیب اسید استیک و استات سدیم تهیه می شود و در واکنش های شیمیایی و زیستی با pH پایین کاربرد دارد.
- بافر بازی:
این محلول ها برای حفظ pH در محدوده بازی طراحی شده اند. ترکیب آن ها معمولاً شامل یک باز ضعیف و اسید مزدوج آن است. ویژگی های بافرهای بازی عبارتند از:
- مناسب برای واکنش هایی که نیاز به pH بالا دارند.
- توانایی خنثی سازی یون های H+ و جلوگیری از کاهش pH.
نمونه رایج: بافر آمونیاک، که از ترکیب آمونیاک و کلرید آمونیوم تهیه می شود و در بسیاری از آزمایشات شیمیایی کاربرد دارد.
- بافر طبیعی:
این نوع محلول بافر به طور طبیعی در سیستم های زیستی وجود دارد و نقش حیاتی در تنظیم pH محیط زیست موجودات زنده ایفا می کند. ویژگی های بافرهای طبیعی عبارتند از:
- حفظ تعادل شیمیایی در فرآیندهای بیولوژیکی.
- پیشگیری از تغییرات ناگهانی pH که می تواند به سلول ها و مولکول های زیستی آسیب برساند.
نمونه رایج:
- بافر بی کربنات در خون انسان که pH خون را در محدوده طبیعی حفظ می کند.
- بافر فسفات که در مایعات درون سلولی و برون سلولی یافت می شود.

- بافر صنعتی:
این محلول ها برای استفاده در فرآیندهای صنعتی طراحی شده اند. ویژگی های مهم آن ها شامل موارد زیر می باشد:
- توانایی حفظ pH در شرایط مختلف دما و فشار.
- مقاوم در برابر تغییرات ناشی از مواد شیمیایی صنعتی.
نمونه رایج: بافر های استفاده شده در تصفیه آب و فاضلاب، که pH را برای فرایندهای تصفیه کنترل می کنند.
- بافر آزمایشگاهی:
این نوع محلول بافر به طور گسترده در تحقیقات علمی و آزمایشات مختلف استفاده می شود. ویژگی های آن عبارتند از:
- فراهم کردن شرایط پایدار برای واکنش های شیمیایی و زیستی.
- توانایی حفظ pH در محدوده های مختلف بسته به نیاز آزمایش.
نمونه رایج:
- بافر تریس که در آزمایشات مولکولی و زیستی برای حفظ pH در محدوده خنثی یا بازی کاربرد دارد.
- بافر فسفات که برای کاربردهای زیستی و بیوشیمیایی استفاده می شود.
- بافر مصنوعی:
این نوع بافرها به طور ویژه برای کاربردهای خاص طراحی و ساخته می شوند. ویژگی های این بافرها شامل:
- قابلیت تنظیم دقیق pH برای کاربردهای ویژه.
- استفاده در شرایطی که محلول های طبیعی یا صنعتی کافی نیستند.
نمونه رایج: بافر هپس، که در تحقیقات مولکولی و زیستی پیشرفته کاربرد دارد.
- بافر ترکیبی:
این محلول ها از ترکیب چند اسید یا باز برای دستیابی به محدوده گسترده تری از pH تهیه می شوند. ویژگی های این نوع بافر عبارتند از:
- توانایی عملکرد در محدوده های مختلف pH.
- مناسب برای آزمایش هایی که pH باید در طول فرآیند تغییر کند ولی همچنان کنترل شده باقی بماند.
نحوه تهیه محلول بافر
- انتخاب مواد اولیه:
برای تهیه محلول بافر، باید یک اسید یا باز ضعیف و مزدوج آن را انتخاب کرد. انتخاب این مواد به محدوده pH مورد نظر بستگی دارد. برای مثال:
- برای تهیه یک بافر اسیدی، ترکیباتی مانند اسید استیک و استات سدیم به کار می روند.
- برای تهیه یک بافر بازی، می توان از آمونیاک و کلرید آمونیوم استفاده کرد.
مراحل تهیه محلول بافر:
برای ساخت این نوع محلول بهتر است ابتدا ظروف آزمایشگاهی مورد نیاز را تهیه کنید سپس طبق مراحل زیر پیش بروید:
- ابتدا مقدار مشخصی از اسید ضعیف یا باز ضعیف در آب حل می شود.
- سپس مقدار مناسب از مزدوج آن (باز یا اسید) اضافه شده و محلول به حجم مورد نظر می رسد.
- در نهایت، با استفاده از یک pH متر، pH محلول اندازه گیری و در صورت نیاز تنظیم می شود.
نمونه های رایج محلول های بافر
بافر فسفات: این بافر که از ترکیبات دی هیدروژن فسفات و هیدروژن فسفات ساخته می شود، یکی از پرکاربردترین محلول های بافر در آزمایشات زیستی است. بافر فسفات معمولاً برای حفظ pH در محدوده هفت تا هشت به کار می رود.
_11zon.jpg)
بافر استات: از ترکیب اسید استیک و استات سدیم تهیه می شود و برای واکنش هایی که به pH در محدوده چهار تا پنج نیاز دارند، استفاده می شود. بافر استات در آزمایشات شیمیایی و بیولوژیکی کاربرد گسترده ای دارد.
بافر تریس: تریس یکی از پرکاربردترین ترکیبات در تهیه بافرهای بیولوژیکی است. این ترکیب به دلیل توانایی تنظیم pH در محدوده هفت تا نه برای بسیاری از آزمایشات مولکولی استفاده می شود.
مزایای استفاده از محلول بافر
ثبات شیمیایی: محلول های بافر از تغییرات ناگهانی pH جلوگیری می کنند و شرایط پایدار برای انجام واکنش ها فراهم می کنند. این ویژگی در آزمایشاتی که به دقت بالا نیاز دارند، حیاتی است.
حفاظت از مواد حساس: بسیاری از ترکیبات شیمیایی و زیستی در برابر تغییرات pH حساس هستند. استفاده از محلول بافر از تخریب یا غیرفعال شدن این مواد جلوگیری می کند.
افزایش کارایی واکنش ها: حفظ pH مناسب، بازده واکنش های شیمیایی و بیولوژیکی را افزایش داده و دقت نتایج را تضمین می کند.
کاربرد گسترده در محیط های مختلف: از بدن انسان تا صنایع پیشرفته، محلول های بافر به دلیل ویژگی های منحصر به فرد خود در بسیاری از سیستم ها و فرآیندها نقش اساسی دارند.
نحوه نگهداری محلول های بافری
محلول های بافری به دلیل خاصیت حفظ pH در شرایط خاص، برای بسیاری از آزمایشات و فرآیندهای علمی و صنعتی ضروری هستند. برای حفظ کارایی و عملکرد این محلول ها، نگهداری صحیح آن ها اهمیت زیادی دارد. در این بخش به برخی از نکات کلیدی در نگهداری محلول های بافری پرداخته می شود.
نگهداری در دماهای مناسب: دما یکی از عوامل مهم در حفظ پایداری محلول های بافری است. تغییرات دما می تواند بر pH محلول و همچنین بر واکنش های شیمیایی آن تاثیر بگذارد. در این راستا:
- محلول های بافر باید در دمای اتاق یا دمای مشخصی که در دستورالعمل تهیه محلول ذکر شده است، نگهداری شوند.
- برخی از محلول های بافر ممکن است در دماهای پایین تر برای جلوگیری از تجزیه یا تغییرات شیمیایی به بهترین شکل عمل کنند، بنابراین باید از یخ زدگی یا گرمای زیاد اجتناب شود.
استفاده از ظرف های مناسب: ظرف هایی که برای نگهداری محلول های بافری استفاده می شوند، باید ویژگی هایی مانند مقاومت در برابر مواد شیمیایی و نشت نداشتن داشته باشند. معمولاً از ظروف شیشه ای یا پلاستیکی مخصوص آزمایشگاه برای نگهداری محلول ها استفاده می شود. برخی نکات شامل:
- برای جلوگیری از آلودگی محلول، ظروف آزمایشگاهی باید کاملاً تمیز باشند.
- در صورت استفاده از ظروف پلاستیکی، اطمینان حاصل کنید که پلاستیک با ترکیبات محلول بافر واکنش ندهد.
نگهداری در ظروف دربسته: محلول های بافر باید در ظروف دربسته نگهداری شوند تا از تبخیر آب، آلودگی خارجی یا تغییرات محیطی جلوگیری شود. این کار کمک می کند تا محلول از تماس با هوا، گرد و غبار یا آلودگی های میکروبی مصون بماند و پایداری خود را حفظ کند.
جلوگیری از نور مستقیم: بعضی از ترکیبات محلول بافر ممکن است تحت تأثیر نور مستقیم قرار بگیرند و تجزیه شوند. برای جلوگیری از این مشکل:
- محلول های بافر باید در ظروف مات یا رنگی نگهداری شوند تا از تابش نور مستقیم خورشید جلوگیری شود.
- در صورت امکان، محلول های بافر باید در محیط های تاریک یا کم نور نگهداری شوند.
کنترل pH به طور دوره ای: با گذشت زمان و تحت تأثیر شرایط نگهداری، pH محلول های بافر ممکن است دچار تغییرات جزیی شود. بنابراین، توصیه می شود که:
- محلول های بافر به صورت دوره ای بررسی شوند و در صورت نیاز، pH آن ها تنظیم گردد.
- اگر pH محلول تغییرات قابل توجهی نشان دهد، باید محلول دوباره تهیه شود.
_11zon.jpg)
مراقبت از ترکیبات حساس: در صورت استفاده از محلول های بافری که ترکیبات حساس به شرایط محیطی دارند، مانند آنزیم ها یا مواد شیمیایی خاص:
- باید اطمینان حاصل شود که محلول بافر در شرایط محیطی مناسب، از جمله دما و نور، نگهداری می شود.
- برخی از محلول های بافر ممکن است نیاز به ذخیره سازی در یخچال یا فریزر داشته باشند تا از تخریب مواد حساس جلوگیری شود.
چک کردن تاریخ انقضا: محلول های بافر نیز مانند سایر مواد شیمیایی دارای تاریخ انقضا هستند. با گذشت زمان، کارایی محلول بافر کاهش می یابد و احتمال تغییرات در pH وجود دارد. بنابراین:
- بهتر است که تاریخ انقضا و زمان نگهداری محلول بافر را همیشه چک کنید.
- در صورتی که محلول بافر قدیمی شده باشد یا به درستی ذخیره نشده باشد، بهتر است محلول جدیدی تهیه شود.
نحوه عملکرد بافرها
بافرها به طور خاص برای حفظ pH محلول در برابر تغییرات اسیدی یا تغییرات بازی طراحی شده اند. عملکرد آن ها به این صورت است که می توانند به طور مؤثر یون های هیدروژن (H+) یا هیدروکسیل (OH-) را جذب یا آزاد کنند و از تغییرات زیاد pH جلوگیری نمایند. این ویژگی به دلیل وجود یک اسید ضعیف و یا باز ضعیف همراه با نمک آن ها در محلول است.
عملکرد بافرها در برابر افزودن اسید: هنگامی که مقداری اسید به محلول بافر افزوده می شود، اسید حاوی یون های هیدروژن (H+) است که می توانند pH محلول را کاهش دهند. در این حالت، باز ضعیف موجود در بافر وارد عمل می شود و یون های هیدروژن اضافی را جذب می کند، در نتیجه pH محلول تغییر چندانی نخواهد کرد. این مکانیسم باعث می شود که بافر توانایی حفظ pH در برابر افزوده شدن اسید را داشته باشد.
عملکرد بافرها در برابر افزودن باز: در صورتی که به محلول بافر، باز اضافه شود، این باز حاوی یون های هیدروکسیل (OH-) است که می توانند pH محلول را افزایش دهند. در این حالت، اسید ضعیف موجود در بافر یون های هیدروکسیل را جذب کرده و آنها را به مولکول آب تبدیل می کند. این فرایند باعث می شود که pH محلول چندان تغییر نکند.
تعادل شیمیایی در بافرها: عملکرد بافرها بستگی به تعادل شیمیایی موجود در محلول دارد. برای مثال، در بافرهای اسیدی از یک اسید ضعیف و نمک آن استفاده می شود. این اسید ضعیف می تواند یون های هیدروژن را در صورت نیاز آزاد کند، در حالی که نمک آن می تواند یون های هیدروژن را جذب کند. همین مکانیسم برای بافرهای بازی نیز صدق می کند که از باز ضعیف و نمک آن برای مقابله با تغییرات pH استفاده می کنند.
محدوده عملکرد بافر: بافرها تنها در یک محدوده خاص از pH توانایی عملکرد مؤثر دارند. این محدوده معمولاً به pKa یا pKb اجزای بافر بستگی دارد. بافرها معمولاً بهترین عملکرد خود را در pH ای که در آن pKa یا pKb قرار دارد و یا کمی بالاتر یا پایین تر از آن دارند.
مفهوم ظرفیت بافر چیست؟
ظرفیت بافر به توانایی یک محلول بافری برای مقاومت در برابر تغییرات pH گفته می شود. این ویژگی نشان دهنده مقدار اسید یا بازی است که یک محلول بافر می تواند جذب کند بدون این که pH آن تغییر زیادی کند. به عبارت دیگر، ظرفیت بافر نشان می دهد که یک محلول بافر چقدر می تواند در برابر افزودن اسید یا باز مقاومت کند.
_11zon.jpg)
ظرفیت بافر به دو عامل اصلی بستگی دارد:
- غلظت اجزای بافر: هرچه غلظت اسید ضعیف و باز ضعیف یا نمک آن ها در محلول بیشتر باشد، ظرفیت بافر بالاتر خواهد بود. به عبارت دیگر، محلول بافر با غلظت بالاتر می تواند مقدار بیشتری اسید یا باز را جذب کند و pH خود را ثابت نگه دارد.
- نوع اسید یا باز: قدرت اسید یا باز ضعیف مورد استفاده در محلول بافر نیز بر ظرفیت آن تاثیر دارد. اسیدها و بازهای ضعیف با pKa نزدیک به pH محلول، ظرفیت بالاتری دارند.
ظرفیت بافر معمولاً در شرایطی که pH محلول در محدوده نزدیک به pKa اسید یا باز قرار دارد، بیشترین مقدار خود را دارد. در این شرایط، تعداد بیشتری یون هیدروژن یا هیدروکسیل موجود است که می توانند به راحتی جذب یا آزاد شوند.
طرز تهیه محلول های بافری
تهیه محلول بافر یک فرایند ساده است که در آن معمولاً از ترکیب یک اسید ضعیف و نمک آن یا یک باز ضعیف و اسید مزدوج آن استفاده می شود. این ترکیب به طور طبیعی یک سیستم بافر ایجاد می کند که قادر به حفظ pH محلول در برابر تغییرات جزئی است. برای تهیه محلول بافر، مراحل زیر باید طی شوند:
انتخاب نوع بافر و تعیین pH مورد نظر
اولین قدم در تهیه محلول بافر، انتخاب نوع اسید یا باز ضعیف و تعیین pH مورد نظر است. معمولاً pH مورد نظر باید در محدوده pKa اسید یا باز ضعیف قرار داشته باشد. این نکته اهمیت زیادی دارد زیرا هر محلول بافر فقط در محدوده خاصی از pH می تواند عملکرد بهینه داشته باشد.

محاسبه مقادیر اسید و نمک (یا باز و اسید مزدوج)
برای ساخت محلول بافر، باید نسبت دقیق اسید ضعیف و نمک آن (یا باز ضعیف و اسید مزدوج آن) محاسبه شود. این کار با استفاده از معادله هاندرسون-هاسلبالچ انجام می شود که به صورت زیر است:
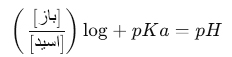
در این معادله:
• pH: pH محلول بافر
• pKa: ثابت تفکیک اسید ضعیف
• [باز]: غلظت یون باز (یا نمک) در محلول
• [اسید]: غلظت یون اسید ضعیف در محلول
با استفاده از این معادله می توان نسبت مناسب اسید و نمک را برای رسیدن به pH دلخواه محاسبه کرد.
- حل کردن مواد در آب مقطر
پس از محاسبه مقادیر لازم از اسید و نمک (یا باز و اسید مزدوج)، این مواد باید به دقت وزن شده و در حجم مشخصی از آب مقطر حل شوند. برای این کار:
• ابتدا مواد را در یک ارلن مایر یا بالن حجم دقیق حل کرده و سپس به آرامی هم بزنید تا کاملاً حل شوند.
• به حجم نهایی محلول باید دقت شود تا محلول بافر به درستی تهیه شود.
- تنظیم pH محلول
پس از تهیه محلول، ممکن است pH محلول بافر کمی از pH دلخواه متفاوت باشد. در این مرحله:
• می توان با افزودن اسید یا باز رقیق شده (بر اساس نیاز) pH را به میزان دلخواه تنظیم کرد.
• برای اندازه گیری pH از پی اچ متر استفاده می شود که به طور دقیق میزان pH محلول را نشان می دهد.
- ذخیره و استفاده از محلول بافر
پس از تهیه محلول بافر و تنظیم pH، محلول باید در ظروف دربسته و در شرایط مناسب (معمولاً دمای اتاق یا طبق دستورالعمل) نگهداری شود. محلول بافر باید از نور مستقیم و آلودگی محیطی محافظت شود تا کارایی آن حفظ گردد.
آدرس: تهران ، اتوبان چمران جنوب - نرسیده به میدان توحید- باقرخان غربی -پلاک ۱۰۱ - واحد ۳
شما میتوانید با تماس با کارشناسان ایمن گستر شیمی از مشاوره رایگان استفاده کرده و ما به صورت کامل پاسخگوی سوالات شما عزیزان هستیم ، همچنین اگر کالای خاصی مد نظر شما باشد در تهیه آن شما را راهنمایی کنیم .
